Aufgaben rund ums PSE
Download Aufgaben rund um das PSE (PDF, 44 KB)
Download Aufgaben rund um das PSE (DOC, 200 KB)
Download Aufgaben rund um das PSE (ODT, 80 KB)
Download Aufgaben rund um das PSE Lösung (PDF, 17 KB)
Download Aufgaben rund um das PSE Lösung (DOC, 108 KB)
Download Aufgaben rund um das PSE Lösung (ODT, 26 KB)
Aufgabe 1
Der Wissenschaftler Weis-von-Nix findet in einem Gemenge folgende vier (frei erfundene) Atomsorten:

Begründen Sie, um wie viele verschiedene Elemente es sich handelt. Welche zählen zu den Edelgasen und in welcher Periode müssten diese Edelgase stehen?
Drei verschiedene Elemente, da drei verschiedene Protonenzahlen. Edelgase sind die Isotope X und Y, ihre Atome besitzen jeweils 8 Valenzelektronen und stehen in der 3. Periode.
Aufgabe 2
Gegeben sind die Atome:
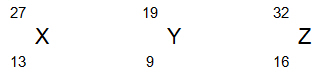
- Geben Sie die jeweilige Elektronenkonfiguration der Atome sowie Gruppe und Periode der Elemente an, denen diese Atome angehören.
Atom X K2, L8, M3 Hauptgruppe III Periode 3 Atom Y K2, L7 Hauptgruppe VII Periode 2 Atom Z K2, L8, M6 Hauptgruppe VI Periode 3 - Um aus den beiden Elementen X und Y einfach positiv geladene Ionen zu erzeugen, müssten bei X 578 kJ/mol und bei Y 1680 kJ/mol aufgewendet werden. In welchem der beiden Atome befände sich das jeweils zu entfernende Elektron näher am Kern?
In Y, da die Ionisierungsenergie umso größer ist, je näher am Kern das zu entfernende Elektron ist.
Aufgabe 3
Ergänzen Sie die Leerstellen in der nachfolgend angegebenen Tabelle:
| Element | OZ | Periode | Hauptgruppe | äußerste Energiestufe | Anzahl Valenzelektronen |
| A | 6 | 2 | IV | L | 4 |
| B | 20 | 4 | II | N | 2 |
| C | 2 | 1 | VIII | K | 2 |
| D | 17 | 3 | VII | M | 7 |
Aufgabe 4
Überprüfen Sie die nachfolgenden Behauptungen, entscheiden Sie, ob diese richtig oder falsch sind und stellen Sie die falschen Aussagen richtig.
- Einfach positiv geladene Wasserstoff-Ionen haben im Kern jeweils ein Proton mehr als Wasserstoffatome.
falsch, …. haben jeweils die gleiche Kernprotonenzahl - Ein Ion hat im Vergleich zum entsprechenden neutralen Atom in jedem Fall weniger Elektronen.
falsch, …. weniger oder mehr Elektronen - Edelgase zeichnen sich durch dieselbe Elektronenanzahl aus.
falsch, …. jedes Edelgas hat eine eigene, unterschiedliche Elektronenzahl - Fluoratome gehen unter Aufwand von Ionisierungsenergie in Fluorid-Ionen über.
falsch, …. unter Freisetzung von Energie (Elektronenaffinität) in Fluoridionen über - Magnesium-Ionen haben einen größeren Radius als Magnesiumatome.
falsch, …. Magnesium als Metall bildet Kationen und diese sind kleiner als die Atome - Anionen besitzen stets einen kleineren Radius als die zugrunde liegenden Atome.
falsch, …. einen größeren Radius - Ein Natriumkation ist viel weniger reaktiv als ein Natriumatom.
richtig
Aufgabe 5
Die Elemente mit den Ordnungszahlen 4, 8 und 12 besitzen unterschiedliche Atomradien. Ordnen Sie die Elemente nach steigender Größe der Atomradien und begründen Sie Ihre Entscheidung.
8 < 4 < 12. Innerhalb der Periode nimmt der Radius ab, da die Kernanziehungskraft zunimmt (8 < 4). Das Element mit der OZ 12 steht unter dem mit der OZ 4, d. h. eine Energiestufe wird neu besetzt. Dies geht mit einer Radiusvergrößerung einher.
Aufgabe 6
Auf welche der nicht radioaktiven Elemente treffen im gekürzten PSE folgende Eigenschaften zu:
- größter/kleinster Atomradius
größter Atomradius: Cs / kleinster Atomradius: H - größter/kleinster Ionenradius
größter Ionenradius: Te 2- / kleinster Ionenradius: H+ - höchste/niedrigste Ionisierungsenergie für das erste Valenzelektron
höchste Ionisierungsenergie: He / kleinste Ionisierungsenergie: Cs
Aufgabe 7
Welches ist im gekürzten PSE das am ausgeprägtesten metallische Element, wenn man den Metallcharakter nach der Fähigkeit beurteilt, Elektronen abzugeben? Welches ist das am ausgeprägtesten nichtmetallische Element, wenn man den Nichtmetallcharakter nach der Fähigkeit beurteilt, Elektronen aufzunehmen? Wie lässt sich diese jeweilige Eigenschaft aus der Elektronenkonfiguration der beiden Elemente begründen?
Am meisten ausgeprägtes metallisches Element: Caesium
Am meisten ausgeprägtes nichtmetallisches Element: Fluor
Aufgabe 8
Unter dem Ionisierungspotential versteht man die Mindestenergie, die zur Entfernung eines Elektrons aus einem Atom benötigt wird. Sie wird in Elektronenvolt angegeben. Ordnen Sie die Werte 4,339; 5,390; 5,138; 3,893 und 4,176 (alle in eV) den Elementen Lithium, Natrium, Kalium, Rubidium und Caesium zu. Begründen Sie die Zuordnung.
Zuordnung: Li 5,390; Na 5,138; K 4,339; Rb 4,176; Cs 3,893 eV
Begründung: Die Atomradien nehmen zu, der Abstand der Außenelektronen vom Kern wird größer, die Kernkräfte werden durch mehr innere Schalen abgeschirmt, die Ablösung ist also beim Lithium schwerer als beim Caesium.
Aufgabe 9
Ordnen Sie die Werte - 3,61; - 3,06; - 3,36 (alle in eV) für die Elektronenaffinität den Elementen Chlor, Brom und Iod zu. Begründen Sie die Zuordnung.
Zuordnung: Chlor - 3,61 eV; Brom - 3,36 eV; Iod - 3,06 eV
Begründung: Durch Einbau eines Elektrons in ein Halogenatom entsteht eine stabile Außenschale (Oktettregel). Dabei wird Energie frei. Der Abstand der Außenschale vom Kern ist beim Chlor am geringsten, die Kernkräfte sind hier am wirksamsten, das Elektron wird am leichtesten eingebaut.
Aufgabe 10
Unter dem Ionisierungspotential versteht man die Mindestenergie, die zur Entfernung eines Elektrons aus einem Atom benötigt wird. Sie wird in Elektronenvolt angegeben. Ordnen Sie die Werte 24,85; 21,56; 12,13; 10,75; 14,00 und 15,76 (alle in eV) den sechs Edelgasen zu und begründen Sie Ihre Zuordnung.
Zuordnung: He 24,58 eV; Ne 21,56 eV; Ar 15,76 eV; Kr 14,00 eV; Xe 12,13 eV; Rn 10,75 eV
Begründung; Die Atomradien nehmen von Helium zum Radon zu, der Abstand der Außenelektronen vom Kern wird größer, die Kernkräfte werden durch mehr innere Schalen abgeschirmt, die Ablösung eines Elektrons ist demzufolge beim Helium schwerer als beim Radon.
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.



