Übungsaufgaben Säuren-Basen-Protolyse
Download Übungsaufgaben Säuren-Basen-Protolyse (PDF, 8KB)
Download Übungsaufgaben Säuren-Basen-Protolyse (DOC, 34 KB)
Download Übungsaufgaben Säuren-Basen-Protolyse (ODT, 10 KB)
Download Übungsaufgaben Säuren-Basen-Protolyse Lösung (PDF, 213 KB)
Download Übungsaufgaben Säuren-Basen-Protolyse Lösung (DOC, 41 KB)
Download Übungsaufgaben Säuren-Basen-Protolyse Lösung (ODT, 14 KB)
1.1 Formulieren Sie für die angegebenen Teilchen jeweils eine Säure-Base-Reaktion in wässriger Lösung und geben Sie die Lage des GG an.
a) H3PO4 + NH3 b) H2SO4 + OH- c) CH3COOH + NH3 d) H2S + CH3COO-
1.2 Formulieren Sie für alle in Aufgabe 1.1 angegebenen Teilchen das korrespondierende Säure-Base-Paar.
| a) | H3PO4 | + | NH3 | ⇄ | H2PO4- | + | NH4+ |
| S I | B II | B I | S II | ||||
| b) | H2SO4 | + | OH- | ⇄ | H2SO4- | + | H2O |
| S I | B II | B I | S II | ||||
| c) | CH3COOH | + | NH3 | ⇄ | CH3COOH- | + | NH4+ |
| S I | B II | B I | S II | ||||
| d) | H2S | + | CH3COO- | ⇄ | HS- | + | CH3COOH |
| S I | B II | B I | S II |
2. Formulieren Sie mit den nachfolgend angegebenen Teilchen denkbare Säure-Base-Reaktionen mit Wasser. Bei welchen Teilchen handelt es sich um Ampholyte?
H2SO4 , NH3 , H2CO3, HCO3- , CH3COOH, HNO3, H3PO4
| H2SO4 | + | H2O | ⇄ | HSO4- | + | H3O+ | |
| NH3 | + | H2O | ⇄ | NH4+ | + | OH- | |
| H2CO3 | + | H2O | ⇄ | HCO3- | + | H3O+ | |
| HCO3- | + | H2O | ⇄ | H2CO3 | + | OH- | |
| H3PO4 | + | H2O | ⇄ | H2PO4- | + | H3O+ | |
| CH3COOH | + | H2O | ⇄ | CH3COO- | + | H3O+ | |
| HNO3 | + | H2O | ⇄ | NO3- | + | H3O+ |
3. Berechnen Sie den pH-Wert einer Lösung, die durch Einleiten von 0,001 mol Chlorwasserstoff in Wasser hergestellt worden ist und das Volumen V= 1 l besitzt.
c0(HCl) = c(H3O+)= 0,001 mol/l
pH = - log (0,001) = 3
4. Ein Liter einer gesättigten Magnesiumhydroxid-Lösung (Mg(OH)2) enthält 6,5 · 10-5 mol Magnesiumhydroxid.
Berechnen Sie den pH-Wert der Lösung.
Für Metallhydroxid (Me(OH)n) –Lösungen gelten:
c(OH-) = n · c (Me(OH)n) = 2 · 6,5 · 10-5 mol
pOH = - log (2 · 6,5 · 10-5) = 3,9
pH = 14 – 3,9 = 10,1
5. Schätzen Sie für die folgenden Säure-Base-Reaktionen die Gleichgewichtslage ab.
a) CH3COOH + NH3
b) H2S + CO32-
| a) | CH3COOH | + | NH3 | ⇄ | CH3COO- | + | NH4+ |
| pKs = 4,76 | pKs = 9,24 | ||||||
| Gleichgewicht liegt auf der rechten Seite, bei der schwächeren Säure. | |||||||
| b) | H2S | + | CO32- | ⇄ | HS- | + | HCO3- |
| pKs = 7,06 | pKs = 10,4 | ||||||
| Gleichgewicht liegt auf der rechten Seite, bei der schwächeren Säure. | |||||||
6. Ein für den Gebrauch im Haushalt geeigneter Essig sollte im Liter ungefähr 50 g reine Essigsäure enthalten. Er kann durch Verdünnung von Essigessenz selbst hergestellt werden.
Die Überprüfung eines so hergestellten Essigs kann auf folgende Weise durchgeführt werden: 10 ml Essig werden mit einer Vollpipette in einen Erlenmeyerkolben gegeben, verdünnt und mit Natronlauge der Stoffmengenkonzentration c = 1 mol/l titriert. Der Verbrauch an Natronlauge beträgt V(NaOH) = 9,25 ml.
Entspricht dieser Essig der genannten Vorgabe?
| n(CH3COOH) | = | c(NaOH) · V(NaOH) mit | |
| n(CH3COOH) | = | 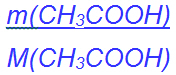 |
|
| m(CH3COOH) | = | c(NaOH) · V(NaOH) · M(CH3COOH) | |
| = | 1 mol/l · 0,00925 l · 60,1 g/mol | ||
| = | 0,556 g |
Herausgeber: Landesbildungsserver Baden-Württemberg
Quelle: https://www.schule-bw.de
Bitte beachten Sie eventuell abweichende Lizenzangaben bei den eingebundenen Bildern und anderen Dateien.



