Aminosäuren – Eigenschaften
Download Aminosäuren – Eigenschaften (PDF, 282 KB)
Download Aminosäuren – Eigenschaften (DOC, 375 KB)
Download Aminosäuren – Eigenschaften (ODT, 156 KB)
Download Aminosäuren – Eigenschaften Lösung (PDF, 152 KB)
Download Aminosäuren – Eigenschaften Lösung (DOC, 372 KB)
Download Aminosäuren – Eigenschaften Lösung (ODT, 127 KB)
Was ist eine Aminosäure?
Proteine sind gewöhnlich aus 20 (21) verschiedenen Aminosäuren aufgebaut. Bei diesen biochemisch wichtigen Aminosäuren ist die Aminogruppe am gleichen Kohlenstoffatom gebunden, das auch die Carboxylgruppe trägt. Wenn man vom Kohlenstoffatom der Carboxylgruppe aus zu zählen beginnt, sitzt die Aminogruppe am ersten Kohlenstoffatom (α-C-Atom). Man spricht daher auch von α‑Amino-säuren. Es gibt auch β- und γ-Aminosäuren. Sie wurden in Naturstoffen nachgewiesen. Die verschiedenen Aminosäuren unterscheiden sich im Aufbau der Seitenkette.
Genau genommen müsste man von Amino-Carbonsäuren sprechen.
Aufgabe 1
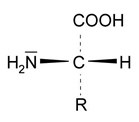
Zeichnen Sie die allgemeine Formel einer α‑Aminosäure, welche am α-C-Atom eine Seitenkette R trägt.
Bisher sind über 300 weitere natürlich vorkommende Aminosäuren bekannt. Viele dieser „seltenen“, nicht proteinogenen Aminosäuren entstehen durch spezifische chemische Veränderungen der Aminosäure-Reste. Sie haben eine Vielzahl von biologischen Funktionen. So wirken zum Beispiel die Neurotransmitter GABA (γ-Aminobuttersäure), Adrenalin und Dopamin als Botenstoffe bei der Kommunikation zwischen Zellen, Thyroxin als Schilddrüsenhormon und Histamin wird bei allergischen Reaktionen freigesetzt.
Abgesehen vom einfachsten Fall, bei dem die Seitenkette ein Wasserstoffatom ist, sind an das α-Kohlenstoffatom vier verschiedene Substituenten gebunden. Es ist daher ein asymmetrisches Kohlenstoffatom, was zum Auftreten optischer Aktivität führt. Das heißt, die Ebene linear-polarisierten Lichts wird gedreht. Es hat sich herausgestellt, dass die in natürlichen Proteinen vorkommenden Aminosäuren aus-schließlich die L-Konfiguration besitzen. Die zugehörigen Reinstoffe nennt man L-α-Aminosäuren. Die nur selten natürlich vorkommenden D-Aminosäuren werden häufig als Antibiotika verwendet (z. B. Gramicidin S, ein bakterielles Peptid). Die optische Aktivität der Aminosäuren überträgt sich auch auf die Proteine und von ihnen katalysierte Reaktionen, bei denen meistens nur eine bestimmte Konfiguration als Edukt erkannt wird und eine Konfiguration als Produkt entsteht.
Aufgabe 2
Welche der 20 natürlich vorkommenden L-α-Aminosäuren ist nicht chiral?
Glycin, da R ein Wasserstoffatom ist.
Aufgabe 3
Ist das in Wassermelonen vorkommende Citrullin eine Aminosäure? Markieren Sie alle asymmetrischen Kohlenstoff-Atome. Nehmen Sie ein Molekülmodell von Citrullin zu Hilfe. Begründen Sie die Antworten.
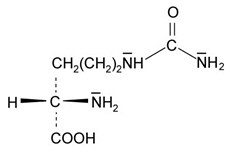
Ja. Nur das C-Atom mit den 4 verschiedenen Substituenten ist chiral. Die C-Atome der Seitenkette sind nicht chiral.
Aufgabe 4
Wie lautet der systematische Name (IUPAC-Bezeichnung) von Alanin?
2-Amino-Propansäure
Aminosäuren sind Proteinbausteine
Aminosäuren sind in Proteinen kovalent (durch Atombindung) verbunden und bilden lange, unverzweigte Ketten. Jede dieser proteinogenen Aminosäuren besitzt eine charakteristische Seitenkette, die in Struktur, Größe und Ladung variiert und die chemischen Eigenschaften bestimmt.
Durch verschiedene Methoden, z. B. Erhitzen mit Säure, lassen sich Proteine in die sie aufbauenden Aminosäuren spalten. Alle proteinogenen Aminosäuren haben Trivialnamen, die sich in einigen Fällen von den Quellen ableiten, aus denen sie zu-erst isoliert wurden. So wurde Asparagin zuerst im Spargel (lateinisch: Asparagus) und Tyrosin in Käse (griechisch: Tyros) gefunden. Glycin wurde nach seinem süßen Geschmack (griechisch: glycos, süß) benannt. Den proteinogenen Aminosäuren wurden Drei-Buchstaben–Abkürzungen und Ein-Buchstaben-Symbole zugeord-net. Mit dieser Kurzschrift werden Zusammensetzung und Sequenz von Proteinen angegeben.
Acht der zwanzig Aminosäuren müssen dem menschlichen Organismus mit der Nahrung zugeführt werden; man nennt sie essentielle Aminosäuren. Beim Fehlen von essentiellen Aminosäuren in der Nahrung gerät die Proteinsynthese ins Stocken und als Folge stellen sich lebensbedrohliche Mangelerscheinungen ein.
Die verzweigtkettigen Aminosäuren Valin, Leucin, Isoleucin und Threonin sowie die aromatischen Aminosäuren Phenylalanin und Tryptophan sind für uns Menschen essentiell. Außerdem sind die Aminosäuren Methionin und Lysin und für Kleinkinder zusätzlich Histidin essentiell.
Es gibt einige angeborene Stoffwechselstörungen, bei denen Enzyme, die zur Biosynthese bestimmter Aminosäuren benötigt werden, ausfallen.
Bekanntestes Beispiel ist die Phenylketonurie (eine Erbkrankheit mit geistiger Retardierung). Bei dieser Krankheit kann aufgrund eines fehlenden Enzyms Phenylalanin nicht in Tyrosin umgewandelt werden. Tyrosin ist für diese Menschen eine essentielle Aminosäure.
Im Gegensatz zu Säugetieren können Pflanzen und Mikroorganismen alle 20 Aminosäuren selbst synthetisieren.
Aufgabe 5
Die Aminosäure Prolin weist eine strukturelle Besonderheit auf, welche sie deutlich von den anderen Aminosäuren unterscheidet. Welche Besonderheit ist dies?
Prolin hat eine sekundäre Aminogruppe (eine Iminogruppe), dadurch entsteht die cyclische Form der Seitenkette.
Aufgabe 6
Faule Eier riechen nach Schwefelwasserstoff. Welche Aminosäuren sind verantwortlich?
Methionin und Cystein. Beim Abbau von Proteinen durch Mikroorganismen entsteht Schwefelwasserstoff aus diesen schwefelhaltigen Aminosäuren.
Einteilung der Aminosäuren
Unpolare, polare und geladene Aminosäuren
Wodurch werden die unterschiedlichen physikalischen und chemischen Eigenschaften der Aminosäuren bestimmt?
Durch die Natur der verschiedenen Aminosäuren-Seitenketten!
Im Arbeitsblatt sind die 20 proteinogenen Aminosäuren zusammengestellt. Je nach Beschaffenheit der Seitenkette wird eine Einteilung in 3 Untergruppen vorgenommen. Die Klassifizierung erfolgt meistens anhand der Polarität der Seitenkette in unpolare (lipophile) Aminosäuren, polare (hydrophile) Aminosäuren und geladene Aminosäuren. Letztere besitzen eine zusätzliche Amino- oder Carboxyl-gruppe.
- Unpolare Seitenketten
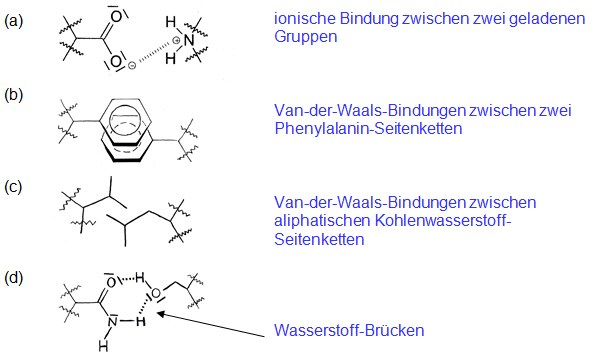
Die Vertreter dieser Klasse können untereinander hydrophobe, d. h. Van-der-Waals-Bindungen eingehen. Diese sind besonders stark, wenn die aromatischen Gruppen übereinander gestapelt vorliegen.
Hierzu zählt man Aminosäuren mit Kohlenwasserstoff-Seitenketten und Methionin, dessen Seitenkette in vielen physikalischen Eigenschaften einem Kohlenwasserstoff-Rest gleicht (das Schwefelatom hat ungefähr die gleiche Größe wie eine CH2-Gruppe und C und S haben ähnliche Elektronegativität).
Aufgabe 7
Listen Sie hier die Aminosäuren mit unpolarer Seitenkette auf.
Glycin
aliphatischer Kohlenwasserstoffrest: Alanin, Valin, Leucin, Isoleucin, Prolin
aromatischer Rest: Phenylalanin, Tryptophan und Tyrosin werden auch zu den Aminosäuren mit aromatischen Seitenketten gezählt. Die Seitenkette von Phenylalanin ist unpolar. Die Seitenketten von Tryptophan und Tyrosin können Wasserstoff-Brücken bilden.
- Ungeladene polare Seitenketten
Die Seitenketten der Vertreter dieser Gruppe können mit Wasser und untereinander Wasserstoff-Brücken ausbilden.
Aufgabe 8
Listen Sie hier die Aminosäuren mit ungeladener, polarer Seitenkette auf.
Hydroxy-Gruppe -OH: Serin, Threonin, Tyrosin
Amid-Gruppe -CO-NH2: Asparagin, Glutamin
Thiol-(SH-) Gruppe: Cystein
Methionin
Methionin und Cystein kommen wegen der geringen Polarität ihrer Seitenketten in hydrophober Umgebung vor.
- Geladene polare Seitenketten
Zwischen den geladenen Gruppen dieser Aminosäuren können sich ionische Bindungen ausbilden.
Aufgabe 9
Listen Sie hier die Aminosäuren mit geladener Seitenkette auf.
Überlegen Sie, in welchen Seitenketten bei pH = 7 geladene Gruppen vorliegen können.
positiv geladene Seitenkette: Lysin, Arginin, Histidin
negativ geladene Seitenkette: Glutamat, Aspartat (ionisierte Form von Glutaminsäure und Asparaginsäure)
Aufgabe 10
Bezeichnen Sie die zwischenmolekularen Kräfte in den folgenden Abbildungen. Zeichnen Sie bei (c) und (d) die zwischenmolekularen Kräfte ein.
Aufgabe 11
Nennen Sie mindestens 3 Merkmale, wie sich die Seitenketten der 20 Aminosäuren voneinander unterscheiden.
Polarität
Acidität/Basizität
Größe
Aromatizität (C6er-Ringe mit drei Doppelbindungen respektive 6 delokalisierten Elektronen, die auch als Kreis dargestellt werden können, gehören z. B. zu den aromatischen Verbindungen)
konformationelle Flexibilität (d. h. Möglichkeit zur Einnahme verschiedener Konformationen)
Fähigkeit zur Wasserstoff-Brückenbildung



