Aminosäuren – Versuche
Download Aminosäuren – Versuche (PDF, 249 KB)
Download Aminosäuren – Versuche (DOC, 292 KB)
Download Aminosäuren – Versuche (ODT, 243 KB)
Download Aminosäuren – Versuche Lösung (PDF, 50 KB)
Download Aminosäuren – Versuche Lösung (DOC, 72 KB)
Download Aminosäuren – Versuche Lösung (ODT, 38 KB)
Eigenschaften der Aminosäuren
Versuch 1: Löslichkeit von Aminosäuren
Zeitbedarf: 10 Minuten
Material: Reagenzgläser, Spatel, Glycin, Phenylalanin
Durchführung:
- Geben Sie zu 2 ml destilliertes Wasser spatelweise so viel Glycin, bis sich nichts mehr löst. Nach Zugabe jeder Spatelspitze schütteln Sie. Merken Sie sich, wie viele Spatel Sie schon zugegeben haben, bevor sich nichts mehr löst. Geben Sie höchstens 10 Spatelspitzen zu.
- Wiederholen Sie das Experiment mit Phenylalanin.
Beobachtungen:
Notieren Sie Ihre Ergebnisse in der folgenden Tabelle.
Entsorgung: Abguss
Frage zu Versuch 1
Erklären Sie mit Hilfe der Strukturformeln die verschiedenen Löslichkeiten der Aminosäuren Glycin und Phenylalanin.
Schätzen Sie die Löslichkeit der Aminosäuren Glutaminsäure und Leucin ab.
|
Glycin: |
R = H Das Wasserstoffatom beeinträchtigt die Löslichkeit von Glycin nicht. Die Löslichkeit von Glycin wird durch die Carboxylgruppe und die Amino-gruppe mehr geprägt. |
sehr gute Wasserlöslichkeit |
|
Phenylalanin: |
R = aromatischer, hydrophober Rest Es werden bevorzugt Van-der-Waals-Bindungen zwischen den Phenylresten ausgebildet, so kommen nur ganz schwache Wechselwirkungen mit Wasser zustande. |
sehr schlechte Wasserlöslichkeit |
|
Glutaminsäure: |
R = geladener, hydrophiler Rest Die Hydratisierung des geladenen Restes (Carboxylanion) ermöglicht eine gute Wasserlöslichkeit. Es entsteht eine Komplex-Bindung zwischen Wassermolekülen und geladenen Resten. |
sehr gute Wasserlöslichkeit |
|
Leucin: |
R = ungeladener, hydrophober Rest Es werden bevorzugt Van-der-Waals-Bindungen zwischen den Kohlenwasserstoff-Seitenketten ausgebildet. Es kommen nur ganz schwache Wechselwirkungen mit Wasser zustande. |
schlechte Wasserlöslichkeit |
|
Serin: |
R = polarer hydrophiler Rest Die Hydroxylgruppe kann Wasser-stoff-Brücken mit Wassermolekülen ausbilden. |
gute Wasserlöslichkeit |
Versuch 2: Pufferwirkung von Aminosäuren
Zeitbedarf: 20 Minuten
Material: 4 Bechergläser 25 ml, Messpipette (2 ml), pH-Meßgerät, Glycinlösung c = 0,1 mol/l, HCl und NaOH c = 1 mol/l
Durchführung:
- Füllen Sie die Bechergläser 1) und 2) mit je 20 ml Leitungswasser und die Bechergläser 3) und 4) mit je 20 ml der Glycinlösung.
- Verfolgen Sie den pH-Wert in den Bechergläsern 1) und 3) bei Zusatz von insgesamt 2 ml der HCl in 0,5 ml Portionen. Tragen Sie die Messwerte in unten stehende Tabelle ein.
- Verfolgen Sie den pH-Wert in den Bechergläsern 2) und 4) bei Zusatz von 2 ml der NaOH in 0,5 ml Portionen.
- Tragen Sie die Messwerte in untenstehende Tabelle ein.
Beobachtung:
|
Zugabe in ml |
gemessener pH-Wert bei Zugabe zu |
||
|
Leitungswasser |
Glycin-Lösung |
||
|
HCl |
0 |
Anfangs-pH-Wert: |
Anfangs-pH-Wert: |
|
0,5 |
|
|
|
|
1 |
|
|
|
|
1,5 |
|
|
|
|
2 |
|
|
|
|
NaOH |
0 |
Anfangs-pH-Wert: |
Anfangs-pH-Wert: |
|
0,5 |
|
|
|
|
1 |
|
|
|
|
1,5 |
|
|
|
|
2 |
|
|
|
Entsorgung: Abguss
Auswertung: Tragen Sie alle Messwerte in das Diagramm ein.
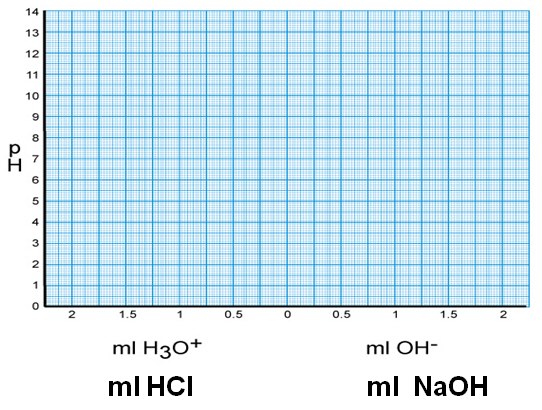
Fragen zu Versuch 2
2.1 Wie liegt Glycin in wässriger Lösung bei pH 11 vor? Welche Ladung trägt Glycin?
Zeichnen Sie die Strukturformel!
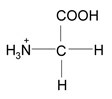
Begründung:
Bei tiefem pH-Wert liegt eine hohe Konzentration an Hydronium-Ionen (H3O+) vor.
Carboxylgruppe und Aminogruppe werden protoniert.
Gesamtladung: einfach positiv geladen.
2.2 Wie liegt Glycin in wässriger Lösung bei neutralem pH vor? Zeichnen Sie die Strukturformel!
|
Glycin |
pKS-Wert |
|
Carboxylgrupe |
2.34 |
|
a-Aminogruppe |
9.60 |
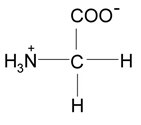
Bei neutralem pH-Wert ist die Carboxylgruppe deprotoniert (pKS = 2.34) und die Aminogruppe noch nicht deprotoniert (pKS = 9.60).
Die Carboxylgruppe liegt folglich als negativ geladene Carboxylat-Gruppe vor, die Aminogruppe als positiv geladene Ammonium-Gruppe. Daher trägt Glycin im neutralen pH-Bereich sowohl eine positive als auch eine negative Ladung. Es ist ein „inneres Salz“ bzw. ein Zwitter-Ion.
Gesamtladung: neutral.
2.3. Glycin ist eine ca. 100-mal stärkere Säure als Essigsäure (pKS = 4.76). Wie erklären Sie sich das?
Das stark elektronegative Stickstoff-Atom des Glycins zieht auch aus der O-H Bin-dung der Carboxylgruppe Elektronanteile an sich. Die O-H Bindung wird dadurch stärker polar als die der Essigsäure, d. h. das Wasserstoff-Kation der Carboxyl-Gruppe im Glycin wird leichter abgespalten. Glycin ist somit eine stärkere Säure als Essigsäure.
Versuch 3: Leitfähigkeit von Aminosäuren
Zeitbedarf: 15 Minuten
Material:
- 3 Bechergläser
- 25 ml 3 Messpipetten (2 ml)
- Leitfähigkeitsmessgerät
- Glycinlösung, gesättigt 40 ml
- Salzsäure ca. c(H3O+) = 5 mol/l
- Essigsäure ca. c(H3O+) = 5 mol/l
- Natronlauge ca. c(NaOH) = 5 mol/l
Durchführung:
- Füllen Sie zwei Bechergläser mit je 20 ml gesättigter Glycinlösung und eines mit destilliertem Wasser.
- Messen Sie die Leitfähigkeiten und tragen Sie diese in die Tabelle ein.
- Geben Sie zur einen Glycinlösung 2 ml Natronlauge, und messen Sie die Leitfähigkeit. Tragen Sie den Wert in der Tabelle ein.
- Geben Sie zur zweiten Glycinlösung 2 ml Essigsäure, und messen Sie die Leitfähigkeit. Tragen Sie den Wert in die Tabelle ein.
- Geben Sie anschließend 2 ml Salzsäure zu, und messen Sie die Leitfähigkeit. Tragen Sie den Wert in die Tabelle ein.
- Wiederholen Sie die Prozedur mit dem destillierten Wasser anstelle der Glycinlösung!
Entsorgung: Abguss
|
|
|
Leitfähigkeit in |
|
2
|
destilliertes Wasser |
|
|
ges. Glycinlösung |
|
|
|
3 |
ges. Glycinlösung + 2 ml 5 m Natronlauge |
|
|
4a |
ges. Glycinlösung + 2 ml 5 m Essigsäure |
|
|
4b |
ges. Glycinlösung + 2 ml 5 m Essigsäure |
|
|
5a |
dest. Wasser + 2 ml 5 m Essigsäure |
|
|
5b |
dest. Wasser + 2 ml 5 m Essigsäure |
|
Fragen zu Versuch 3
3.1 Erklären Sie die Ergebnisse des Leitfähigkeitsversuchs.
Glycin leitet bei neutralem pH-Wert in wässriger Lösung den Strom schlecht.
Im neutralen pH-Bereich ist Glycin formal ungeladen, d. h. es trägt gleich viele positive wie negative Ladungen. Daher wandert Glycin nicht im elektrischen Feld.
In stark alkalischer oder stark saurer Lösung liegt Glycin als Anion bzw. als Kation vor. Dann kann Strom geleitet werden.
3.2 Der Schmelzpunkt von kristallinen Aminosäuren liegt mit 250 – 300 °C viel höher als der Schmelzpunkt anderer organischer Moleküle ähnlicher Größe (z. B. Essigsäure 17 °C, Ethanamin – 81 °C). Erklären Sie diese Beobachtung!
Auch in der festen kristallinen Form liegen die Aminosäuren als Zwitter-Ionen vor. Die ionischen Bindungen im Kristallgitter von Aminosäuren sind viel stärker als die Wasserstoff-Brücken, die bei festen Carbonsäuren oder festen Aminen ausgebildet werden können.
3.3 Man nennt den pH-Wert, bei dem ein Molekül in der Summe keine Ladung trägt, isoelektrischen Punkt. Bei diesem pH-Wert (am isoelektrischen Punkt) leiten wässrige Lösungen von Aminosäuren nicht.
Kann Asparaginsäure auch einen isoelektrischen Punkt haben? Wenn ja, liegt er eher im sauren oder im basischen pH-Bereich?
|
Asparaginsäure |
pKS-Wert |
|
Carboxylgruppe |
1.88 |
|
α-Aminogruppe |
9.60 |
|
β-Carboxylgruppe |
3.65 |
Aminosäuren mit einer geladenen Gruppe verhalten sich prinzipiell gleich wie ungeladene Aminosäuren. Nur liegt bei Asparaginsäure der isoelektrische Punkt durch die zusätzliche Carboxylgruppe im sauren Bereich (pH = 2.77).
3.4 Welche der natürlich vorkommenden Aminosäuren leiten in wässriger Lösung bei neutralem pH-Wert den Strom? Geben Sie bei jeder Aminosäure an, ob sie im Gleichspannungsfeld zur Anode oder zur Kathode wandert!
|
Aminosäure |
pKS (Seitenkette) |
|
Asparaginsäue |
3.65 |
|
Glutaminsäure |
4.25 |
|
Histidin |
6.0 |
|
Lysin |
10.53 |
|
Arginin |
12.48 |
Nur die Aminosäuren mit geladener Seitenkette leiten bei neutralem pH-Wert den Strom.
Aspartat und Glutamat wandern zur Anode.
Lysin, Arginin und Histidin wandern zur Kathode.



