Bio- und Chemolumineszenz
Grundlagen: Energetische Kopplung
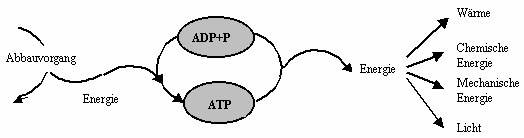
Stoffwechselreaktionen in der Zelle sind entweder exergonisch, d.h. es wird Energie freigesetzt (z.B. Glucoseabbau), oder endergonisch, also Energie verbrauchend (z.B. Aufbau von Proteinen aus Aminosäuren). Wird nun eine endergonische Reaktion mit einer exergonischen verknüpft, die mehr Energie liefert, als die endergonische verbraucht, so ist die Gesamtbilanz beider Reaktionen exergonisch.
Nun laufen aber die verschiedenen Stoffwechselreaktionen in unterschiedlichen Kompartimenten der Zelle ab. Die beim exergonischen Glucoseabbau freiwerdende Energie muss also auf ein Zwischenprodukt übertragen werden, das beweglich ist und an die Orte des Bedarf transportiert werden kann. Dort kann das energiereiche Zwischenprodukt wieder abgebaut werden, die dabei freiwerdende Energie steht nun dem endergonischen Vorgang zur Verfügung.
Für diese Kopplungsreaktion wird in der Zelle in den meisten Fällen ATP als energiereiches Zwischenprodukt benutzt: der Aufbau von ATP aus ADP und anorganischem Phosphat ist eine endergonische Reaktion, beim Abbau von ATP wird also wieder Energie freigesetzt, die dann anderen endergonischen Prozessen zur Verfügung steht.
Chemolumineszenz
1. Chemolumineszenzerscheinungen (Einstiegsexperiment)
Mit Hilfe dieses Versuchs kann den Schülern das Phänomen Lumineszenz veranschaulicht werden.
Grundlagen:
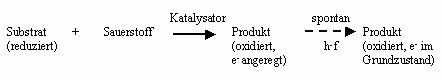
Lumineszenz kommt dadurch zustande, dass durch verschiedene Anregungsprozesse Elektronen in ein höheres Energieniveau angehoben werden, von wo sie unter Lichtemission in den Grundzustand zurückfallen. Bei der Chemolumineszenz stammt die Anregungsenergie von einer chemischen Reaktion. Unter Chemolumineszenz versteht man also eine Leuchterscheinung, die durch Umwandlung chemischer Energie in Licht entsteht. Die Energie stammt dabei meist von einer Oxidationsreaktion, die nach folgendem allgemeinen Schema abläuft:
Materialien:
2 Bechergläser (250ml),
Luminol, Natronlauge (c = 1 mol/L), Wasserstoffperoxid (w = 30%), Kaliumhexacyanoferrat(III)-Lösung (w = 0,1%), ein mit einigen Tropfen Blut getränktes Stück Verbandsmull. Alle angegebenen Konzentrationen sind ungefähre Werte, die nicht genau eingehalten werden müssen.
Durchführung:
0,1 g Luminol werden in 50 mL Natronlauge gelöst und kurz vor Reaktionsstart wird 1ml Wasserstoffperoxid zugegeben. Der Raum wird nun verdunkelt. Die Reaktion wird im Becherglas gestartet, indem man aus einem zweiten Becherglas langsam Kaliumhexacyanoferrat(III)-Lösung (ca.20mL) zugießt.
Es entsteht ein intensives blaues Leuchten.
Die Reaktion kann am Laufen gehalten werden, indem man weitere Kaliumhexacyanoferrat(III)-Lösung zugibt. Verdünnt man die Luminollösung (Luminol, NaOH, Wasserstoffperoxid, s.o.) nochmals 1:10 und gibt dann zu 50mL dieser verdünnten Lösung langsam Kaliumhexacyanoferrat(III)-Lösung zu, so erhält man ein länger andauerndes Leuchten, das langsam verschwindet.
2. Nachweis von Blutspuren durch Chemolumineszenz:
In einem zweiten Versuchsansatz gibt man anstelle von Kaliumhexacyanoferrat(III)-Lösung ein mit einigen Tropfen (angetrocknetem) Blut getränktes Stück Verbandsmull zum Reaktionsgemisch. Auch hier entsteht ein intensives Leuchten, das längere Zeit anhält.
Erklärung:
Wasserstoffperoxid wirkt in alkalischer Lösung oxidierend auf Luminol, Eisenionen katalysieren diese Reaktion. Dabei wird die frei werdende Energie nicht als Wärme, sondern in Form von blauem Licht abgestrahlt.
Setzt man dem Reaktionsgemisch Blut zu, so tritt aus den platzenden Erythrocyten Hämoglobin aus, das diese Reaktion schon in geringen Mengen katalysiert. Die Leuchterscheinung bleibt über Minuten bestehen. Daher kann diese Reaktion zum Nachweis von Blutspuren in der Kriminalistik eingesetzt werden.
Biolumineszenz
Grundlagen:
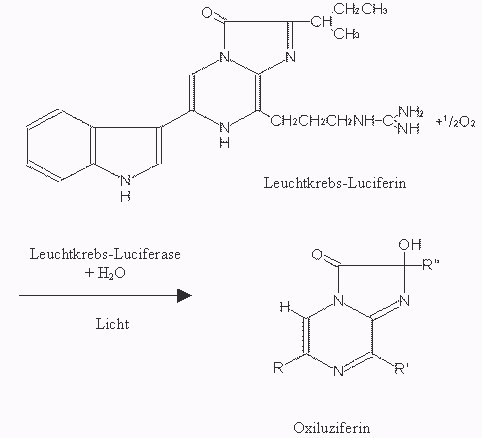
Als Biolumineszenz bezeichnet man das Phänomen der Lichterzeugung durch Lebewesen. Sie ist auf einen chemischen Prozess zurückzuführen, der auf der Oxidation bestimmter Leuchtstoffe, sog. Luziferine beruht. Die dabei mitwirkenden Enzyme werden als Luziferasen bezeichnet.
Die biologische Funktion ist vielfältig, sehr häufig werden die Leuchtsignale zur Partnerwerbung, Täuschung oder als Köder eingesetzt.
Die hier vorgestellten Leuchtsysteme stammen aus folgenden Organismen :
- Cypridinia hilgendorfii, ein in der japanischen See vorkommendes Leuchtkrebschen. Der Leuchteffekt dieser Krebschen wurde während des zweiten Weltkrieges für kurzfristige Leuchtvorgänge im Dschungel benutzt. Die Leuchtkrebschen eignen sich auch für die Durchführung enzymatischer Versuche! Mögliche Versuche sind in der Anleitung der Firma beschrieben.
- Photinus pyralis, der amerikanische Leuchtkäfer. Die Luziferin/Luziferase-Reaktion dieses Leuchtkäfers ist ATP-abhängig und wird deshalb zum empfindlichen quantitativen Nachweis dieser Schlüsselsubstanz verwendet, schon ca. 50 Moleküle ATP können detektiert werden. Da alle bekannten Lebewesen auf ATP angewiesen sind, wird dieser Test auch in der Raumfahrt zum Nachweis extraterrestrischen Lebens oder als Sterilitätstest verwendet.
Materialien:
Leuchtkrebschen (Fa. Schlüter Kit Nr. 2261 oder 2262),
Luciferin/Luciferase-System (Fa. Sigma-Aldrich Kit FFE-15), enthält 5 x Gefäß FLE-50 und 15 x Gefäß FF-ATP
Reibschale mit Pistill, Spritzflasche mit Wasser, Pipette (10ml), Schutzhandschuhe
Durchführung:
Vorsicht: alle Geräte müssen absolut trocken sein!
- ca. 10-15 trockene Krebschen in einer Reibschale pulverisieren
- Raum verdunkeln
- vorsichtig etwas Wasser aus der Spritzflasche zugeben
Beobachtung:
Intensiv blaues Leuchten, das allmählich abklingt.
Erklärung, Reaktionsablauf:
Ergänzende Informationen:
Leuchterscheinungen haben in den letzten Jahren in der molekularbiologischen Forschung einen bedeutenden Stellenwert erhalten. Entscheidend hierfür war die Entdeckung des GFP-Gens in der Leuchtqualle Aequorea victoria (GFP = green fluorescent protein).
Leuchtquallen besitzen das Protein Aequorin, das unter ATP-Verbrauch UV-Licht emittieren kann, welches wiederum GFP zur Emission von grünem Licht anregt.
Das GFP-Gen und zahlreiche im Labor erzeugte Mutanten werden als Reportergene eingesetzt um z.B. die Fragen zu beantworten, wo, zu welchem Zeitpunkt oder in welchem Ausmaß bestimmte Gene aktiv sind. Hierzu wird das GFP-Gen mit dem zu untersuchenden Gen gekoppelt, so dass Fluoreszenz auftritt, wenn das Gen aktiv ist.
Von außerordentlichem Vorteil ist hierbei die Tatsache, dass die Genaktivität an lebenden Zellen untersucht werden kann und dass schon wenige Moleküle detektiert werden können.
Fluoreszenz von GFP im Unterricht vorzuführen ist z.Z. nicht möglich, weil z.B. Bakterien, denen ein Plasmid mit dem GFP-Gen eingesetzt wurde, der S1- Verordnung unterliegen.
Literatur zum Thema Lumineszenz:
D. Nelson, M. Cox, Lehninger Biochemie. 3.Auflage 2001
Chalfie / Kain: Green fluorescent protein, 1998
Bukatsch / Glöckner: Experimentelle Schulchemie, Physikalische Chemie 2 ,1977
Autor: Ursula Gegler-Hertler, Maria von Linden-Gymnasium, 75365 Calw
Webbearbeitung: Ursula Gegler-Hertler