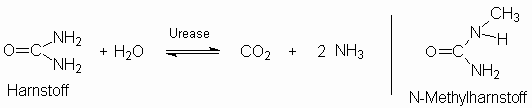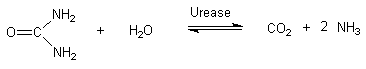Grundlagen:
Katalasen sind Enzyme, die das bei der Zellatmung
anfallende Zellgift Wasserstoffperoxid in Wasser und
Sauerstoff spalten und damit eliminieren. Das Enzym kommt
in allen pflanzlichen und tierischen Organen vor,
besonders in der Leber und in den Erythrozyten.
Aufgaben:
- Führen Sie den Versuch durch. Vorsicht:
Wasserstoffperoxid ist ätzend! Bei Hautkontakt
sofort mit Wasser spülen. Protokollieren Sie
die Beobachtungen.
- Formulieren Sie die Reaktionsgleichung für die
Zersetzung von Wasserstoffperoxid.
- Veranschaulichen Sie ihre Versuchsergebnisse,
indem Sie den Reaktionsverlauf unter Verwendung
verschiedener Farben in ein Energiediagramm
einzeichnen. Ordinate: Energie Abszisse:
Reaktionsverlauf
- Stellen Sie Ihre Ergebnisse und Erkenntnisse dem
Plenum vor.
Materialien:
5 Reagenzgläser (RG), RG-Ständer, Knoblauchpresse,
kleines Becherglas, Spatel, Messer, Glimmspan, Brenner,
Schutzbrille,Wasserstoffperoxid-Lösung (w = 10 %),
Braunstein MnO2, Kartoffel, Trockenhefe
Durchführung:
- Schutzbrille aufsetzen. Anschließend in jedes
der 5 RG etwa 2 ml (eine Daumenbreite)
Wasserstoffperoxid-Lösung einfüllen.
- RG 1: Dient zum Vergleich.
- RG 2: Spatelspitze MnO2 zufügen und
umschütteln.
- RG 3: Kartoffelstückchen zufügen und
umschütteln.
- RG 4: Frisch gepressten Kartoffelbrei
(Knoblauchpresse) zufügen und umschütteln.
- RG 5: Spatelspitze Trockenhefe zufügen und
umschütteln.
- Weisen Sie das entstehende Gas nach! (Wie?)
Station 2:
Die pH-Abhängigkeit der Enzymwirkung
|
Grundlagen:
Sie arbeiten mit Trockenhefe. Diese enthält
Katalase. Katalasen sind Enzyme, die das bei der
Zellatmung anfallende Zellgift Wasserstoffperoxid
in Wasser und Sauerstoff spalten und damit
eliminieren.Das Enzym kommt in allen pflanzlichen
und tierischen Organen vor, besonders in der
Leber und in den Erythrozyten.
Aufgaben:
- Führen Sie den Versuch durch. Vorsicht:
Wasserstoffperoxid ist ätzend! Bei
Hautkontakt sofort mit Wasser spülen.
Protokollieren Sie Ihre Beobachtungen.
- Was schließen Sie aus den
Versuchsergebnissen?
- Stellen Sie Ihre Ergebnisse und
Erkenntnisse dem Plenum vor.
Material:
3 Reagenzgläser (RG), RG-Ständer, Spatel,
Trockenhefe, verd. Salzsäure, verd. Natronlauge,
Wasserstoffperoxid-Lösung (w = 10 %),
Universalindikatorpapier.
Durchführung:
- Schutzbrille aufsetzen und 3 RG mit je
einer Spatelspitze Trockenhefe versehen.
- RG 1: + ca. 2 mL (eine Daumenbreite)
verdünnte Salzsäure, umschütteln und
etwa 5 min lang einwirken lassen
- RG 2: + ca. 2 mL verdünnte Natronlauge,
umschütteln und etwa 5 min lang
einwirken lassen
- RG 3: + ca. 2 mL Leitungswasser,
umschütteln und etwa 5 min lang
einwirken lassen.
- Prüfen Sie zwischenzeitlich den pH-Wert
von Salzsäure, Natronlauge und
Leitungswasser.
- Fügen Sie dann zu allen 3 RG je 1 mL
Wasserstoffperoxid-Lösung zu.
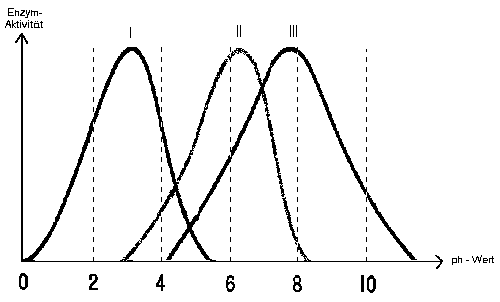
Zusatzaufgabe:
Amylase, Pepsin und Trypsin sind
Verdauungsenzyme, die an verschiedenen Stellen
(Mund, Magen, Dünndarm) unseres
Verdauungstraktes vorkommen und unterschiedliche
Nahrungsbestandteile abbauen.
Ordnen Sie die drei Enzyme den entsprechenden
Kurven im Diagramm (s. unten) zu. Bedenken Sie
dabei, in welchem Milieu die Enzyme jeweils ihre
optimale Wirkung entfalten.
Station 3:
Die
Temperaturabhängigkeit der
Enzymwirkung
Grundlagen:
Sie arbeiten
mit Trockenhefe. Diese enthält
Katalase. Katalasen sind Enzyme,
die das bei der Zellatmung
anfallende Zellgift
Wasserstoffperoxid in Wasser und
Sauerstoff spalten und damit
eliminieren.[1] Das Enzym kommt
in allen pflanzlichen und
tierischen Organen vor, besonders
in der Leber und in den
Erythrozyten.
Aufgaben:
- Führen
Sie den Versuch durch. Vorsicht:
Wasserstoffperoxid ist
ätzend! Bei Hautkontakt
sofort mit Wasser
spülen.
Protokollieren Sie die
Beobachtungen.
- Was
schließen Sie aus den
Versuchsergebnissen?
- Stellen
Sie Ihre Ergebnisse und
Erkenntnisse dem Plenum
vor.
Materialien:
4
Reagenzgläser (RG), RG-Ständer,
Spatel, Schutzbrille, 3 x
400-mL-Bechergläser (für
Wasserbäder 0° C, 20 °C, 37
°C), 3 Thermometer, Brenner,
RG-Klammer, Trockenhefe,
Wasserstoffperoxid-Lösung (w =
10 %), verd. Salzsäure, verd.
Natronlauge, Eis,
Universalindikatorpapier.
Durchführung:
Setzen Sie eine
Schutzbrille auf und bereiten Sie
4 RG vor:
- RG 1: +
Spatelspitze Trockenhefe
+ ca. 1 mL (halbe
Daumenbreite)
Leitungswasser. Kochen
Sie den RG-Inhalt kurz
auf und lassen Sie es
danach abkühlen.
- RG 2: +
ca. 1 mL Leitungswasser +
ca. 2 mL
Wasserstoffperoxid-Lösung,
5 min lang in Eiswasser
stellen.
- RG 3: +
ca. 1 mL Leitungswasser +
ca. 2 mL
Wasserstoffperoxid-Lösung,
5 min lang in Wasserbad
mit der Temperatur des
Leitungswassers stellen.
- RG 4: +
ca. 1 mL Leitungswasser +
ca. 2 mL
Wasserstoffperoxid-Lösung,
5 min lang in Wasserbad
mit 37 °C stellen.
- Fügen Sie
zu RG 1 ca. 2 mL
Wasserstoffperoxid-Lösung
und zu den RG 2-4 je 1
Spatelspitze Trockenhefe
hinzu und vergleichen Sie
nach kurzem Schütteln
die Intensität der
Gasentwicklung.
Zusatzaufgabe:
Bei welcher
Temperatur "arbeiten"
die Enzyme unseres Körpers wohl
am besten?
Die
Reaktionsgeschwindigkeit
chemischer Reaktionen nimmt mit
steigender Temperatur
entsprechend der RGT-Regel zu.
Wie lautet diese Regel?
|
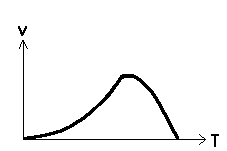
| Bei
biochemischen Reaktionen
(Enzymreaktionen) verhält sich
die Reaktionsgeschwindigkeit ab
einer bestimmten Temperatur
anders. Dies geht aus der
folgenden Grafik hervor. Begründen Sie den
Sachverhalt!
Zeichnen Sie
den Kurvenverlauf nach der
RGT-Regel in das Schaubild ein.
|
 |
Station 4:
Substratspezifität der Urease
|
Grundlagen:
Urease kommt in vielen Pflanzen,
Schimmelpilzen und Bodenbakterien vor.
Der Ammoniakgeruch von Gülle hat seinen
Grund im bakteriellen, enzymatischen
Harnstoffabbau nach folgenden Reaktionen:
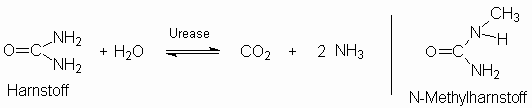
CO2 + 2 NH3 + 2
H2O  2 NH4+
+ HCO3- + OH- 2 NH4+
+ HCO3- + OH-
Aufgaben:
- Führen Sie den Versuch durch und
protokollieren Sie die
Beobachtungen.
- Was schließen Sie aus den
Versuchsergebnissen?
- Stellen Sie Ihre Ergebnisse und
Erkenntnisse dem Plenum vor.
Materialien:
3 Reagenzgläser (RG), RG-Ständer,
Armbanduhr oder Stoppuhr. Frische
Lösungen von Harnstoff (w = 2 %) und
N-Methylharnstoff (w = 2%),
Phenolphthalein-Lösung,
Urease-Suspension (w = 0,1 %) in
Tropfflaschen
Durchführung:
Bereiten Sie 3 RG vor:
- RG 1: Ca. 2 mL (eine
Daumenbreite) Harnstoff-Lösung +
2 Tr. Phenolphthalein
- RG 2: Ca. 2 mL Harnstoff-Lösung
+ 2 Tr. Phenolphthalein
- RG 3: Ca. 2 mL
N-Methylharnstoff-Lösung + 2 Tr.
Phenolphthalein
- Geben Sie zu den
Versuchsansätzen in RG 2 und RG
3 je 1 mL Urease-Suspension und
schütteln Sie kurz um. Stoppen
Sie die Zeit bis zur Pinkfärbung
des Inhalts.
Station 5:
Substrathemmung der Urease
|
Grundlagen:
Urease kommt in vielen
Pflanzen, Schimmelpilzen und
Bodenbakterien vor. Durch einen
bakteriellen, enzymatischen
Harnstoffabbau riecht Gülle
intensiv nach Ammoniak. Diesem
Abbau liegende folgenden
Reaktionen zu Grunde:
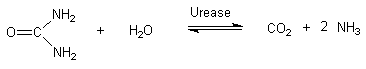
CO2 + 2 NH3
+ 2 H2O  2 NH4+
+ HCO3- +
OH- 2 NH4+
+ HCO3- +
OH-
Aufgaben:
- Führen Sie den Versuch
durch und protokollieren
Sie die Beobachtungen.
- Was schließen Sie aus
den Versuchsergebnissen?
- Stellen Sie Ihre
Ergebnisse und
Erkenntnisse dem Plenum
vor.
Materialien:
3
Reagenzgläser (RG), RG-Ständer,
Armbanduhr oder Stoppuhr. Frische
Harnstofflösung (w = 2 %),
gesättigte Harnstofflösung (w =
50 %), Phenolphthalein-Lösung,
Urease-Suspension (w = 0,1 %) in
Tropfflaschen.
Durchführung:
Bereiten Sie 3
RG vor:
- RG 1: Ca.
2 ml (eine Daumenbreite)
Harnstoff-Lösung (w = 2
%) + 2 Tr.
Phenolphthalein
- RG 2: Ca.
2 ml Harnstoff-Lösung (w
= 2 %) + 2 Tr.
Phenolphthalein
- RG 3: Ca.
2 ml Harnstoff-Lösung (w
= 50 %) + 2 Tr.
Phenolphthalein
Geben Sie zu den
Versuchsansätzen in RG 2 und RG
3 je 1 ml Urease-Suspension und
schütteln Sie kurz um. Stoppen
Sie die Zeit bis zur Pinkfärbung
des Inhalts.
|
|
|
|