Der Indikator Bromthymolblau
Aufgrund des Farbumschlags von gelb nach blau im Bereich des pH: 7 (neutrales Wasser) wird der Indikator Bromthymolblau häufig zur Unterscheidung schwach saurer (gelb), etwa neutraler (grün) und schwach alkalischer Lösungen (blau) herangezogen. Er ist eine Alternative zum früher verwendeten Indikator Lackmus. Im Folgenden werden Hinweise zur Untersuchung der Farbigkeit von Bromthymolblau gegeben.
Vier Küvetten mit wässrigen Bromthymolblau-Lösungen auf der Fensterbank

Wässrige Lösungen von Bromthymolblau haben je nach pH-Wert unterschiedliche Farben. Wie das Foto oben zeigt, sind fünf Farbwahrnehmungen möglich. Im stark sauren (pH: 0) erscheint eine Lösung vom Bromthymolblau rötlich. Bei pH-Werten von ca. 2 - 6,0 ist die Lösung gelb, während bei pH-Werten oberhalb 7,5 eine Blaufärbung eintritt.
Bei den Umschlagbereichen pH ca. 0,5 bis 2 und bei pH 6 bis 7,5 treten Mischfarben (Orange- und Grüntöne) auf. Die unterschiedlichen Farben hängen mit drei verschiedenen Farbstoffen zusammen, die sich in Abhängigkeit vom pH-Wert in Bromthymolblaulösungen bilden.
Lichtabsorption durch Bromthymolblau
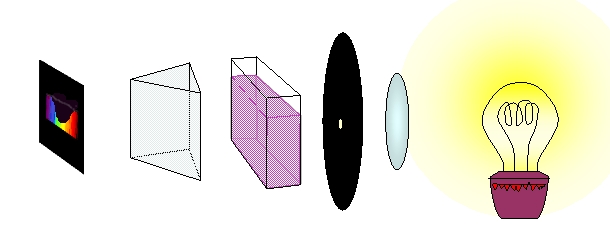
Farbe: Das sichtbare Ergebnis der Wechselwirkung von Licht mit einem Stoff
Das weiße Licht einer Glühfadenlampe, das durch ein Prisma zerlegt wird, zeigt ein kontinuierliches Spektrum.

Wenn man in den Strahlengang eine farbige Lösung einbringt kommen nicht mehr alle Wellenlängenbereiche in gleichem Maße durch und es zeigt sich ein Spektrum aus dem die eine oder andere Lichtfarbe mehr oder weniger verschwunden ist.
Aufbauschema eines Photometers
Je nachdem welcher Stoff sich in der Küvette befindet zeigen sich unterschiedliche Spektren.
Spektren von Bromthymolblau-Lösungen
Zur Anzeige der Spektren bei verschiedenen pH-Werten klicken Sie auf die jeweiligen Links.
| Wasser | pH: 0 | pH: 4 | pH: 8 |
 |
 |
 |
 |
Anzeige des Photometers |
|||
|
Wasser  |
Photometer |
||
| Materialien zur Spektroskopie Tipps zur Aufnahme von Absorptionsspektren (Messkurven) |
|