Rutherford - die Mauer hat Löcher!
|
Nach der Auffassung der alten Griechen waren Atome so etwas wie kleine,
unteilbare und harte Kugeln - zu klein für das Auge. | |
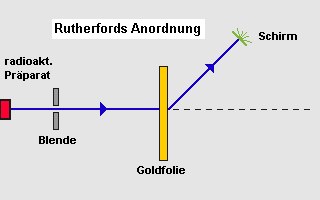 |
Was würde wohl passieren, wenn man eine dünne Goldfolie, hunderte
von Atomlagen stark, mit positiv geladenen Bruchstücken aus einem
radioaktiven Zerfall (Alpha-Teilchen, 2 fach positiv) beschieÃen würde?
|
| |
|
Das letztere trat ein: Rutherford fand zwar, wie er erwartete, dass der gröÃte
Teil der Elektronen einfach die Atomwand durchdrang, jedoch fand er auch -
erstaunlicherweise - unter verschiedenen Winkeln Lichtblitze ! | |
|
Rutherfords Erklärung war folgende (er erhielt dafür 1908 den Nobelpreis): | |
|
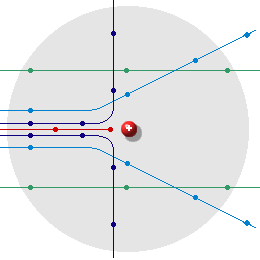 |
Auf Teilchen, die sehr weit am Kern vorbeifliegen, übt der Atomkern fast keine Kräfte aus. Sie fliegen praktisch ungehindert durch das Atom hindurch. Teilchen, die näher am Kern vorbeifliegen werden
je nach Ladung von diesem mehr oder weniger stark abgestoÃen (Teilchen
positiv geladen) oder angezogen (Teilchen negativ geladen). Ein positiv geladenes Teilchen auf "Kollisionskurs"
wird auf dem Weg zum Kern immer mehr abgebremst und kehrt schlieÃlich
um.(Rückstreuung) | |||
|
Beachte, diese Skizze ist nicht maÃstabsgetreu! - Ein Vergleich : | ||||
| ||||
| [ Zur nächsten Seite ] | [ Zur Index-Seite ] | [ Zur Test-Seite ] |


