Raumstrukturen der Proteine
Download Raumstrukturen der Proteine (PDF, 83 KB)
Download Raumstrukturen der Proteine (DOC, 138 KB)
Download Raumstrukturen der Proteine (ODT, 126 KB)
Die AS-Sequenz eines Proteins wird als Primärstruktur bezeichnet. Mit den heute zur Verfügung stehenden Verfahren liefert sie noch wenig Anhaltspunkte über die räumliche Anordnung (= Raumstruktur) von Proteinen.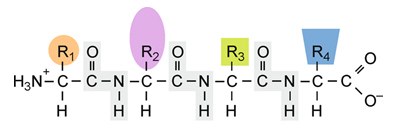
Mit Hilfe moderner Analyseverfahren (z. B. Röntgenstruktur-Analyse) können genauere Einblicke der räumlichen Anordnung gewonnen werden.
Es wird von drei weiteren Ebenen ausgegangen:
Sekundärstruktur
Tertiärstruktur
Quartärstruktur
Zuerst noch mal zurück zur Peptidbindung:
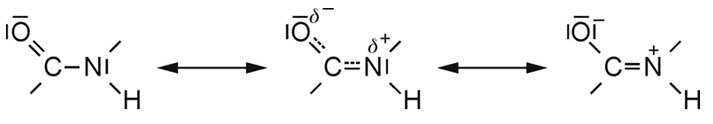
Bisher haben wir die Peptidbindungen als Rückgrat von Peptid- oder Proteinketten als Einfachbindungen gezeichnet. Tatsächlich stellt diese Darstellungsweise nur eine mesomere Grenzstruktur der Peptidbindung dar, die infolge der Elektronenverteilung zwischen der C=O-Bindung und der NH-Bindung den Charakter einer partiellen Doppelbindung erhält. Aus diesem Grund ist die Peptidbindung ein entscheidendes strukturgebendes Element.
Mesomere Grenzstrukturen der Peptidbindung:
Sekundärstruktur:
Lange Polypeptidketten können sich räumlich anordnen:
Wasserstoff-Brückenbindungen zwischen den C=O- und NH-Gruppen der Peptidketten stabilisieren diese räumliche Anordnung.
Man unterscheidet 2 Formen: α-Helix und β-Faltblattstruktur
α-Helix:
Polypeptidkette in Form einer rechtsgewundenen Schraube, entdeckt in α-Kreatinen, den fibrillären Proteinen in Haaren
β-Faltblattstruktur:
Peptidkette in Zick-Zack-Form gefaltet, je nach Richtung der Polypeptid-Ketten wird von parallelen bzw. antiparallelen Faltblättern gesprochen.
Tertiärstruktur:
ist eine weitere räumliche Anordnung der Proteine. Sie beschreibt die Ausbildung der stabilen Raumstruktur monomerer Proteine, die aus Kombinationen von α-Helices und β-Faltblättern sowie den dazwischen liegenden Schleifen und anderen Strukturelementen besteht.
Zur Ausbildung der Tertiärstruktur kommt es durch Wechselwirkungen zwischen den Aminosäure-Seitenketten:
- Wasserstoff-Brücken
- hydrophobe Wechselwirkungen
- Ionenbindungen
- Disulfidbrücken
Quartärstruktur:
Mehrere identische Proteinketten mit eigener Primär-, Sekundär- oder Tertiärstruktur treten zu einer Funktionseinheit zusammen.
Viele Proteine des menschlichen Organismus sind dimer (2 Funktionseinheiten) oder tetramer, die Anzahl kann aber auch wesentlich größer sein.



